- 当前位置:首页 > 时尚 > 碱性蛋白酶降解鲢鱼肌原纤维蛋白的组学分析(三)
游客发表
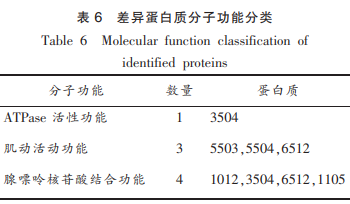
2.3.2差异蛋白质的碱性解鲢分子功能分类
分析鲢鱼肌原纤维蛋白质组的功能情况,将差异蛋白质进行Level8级别上的蛋白基因本体的注释,被分为3个类别。酶降从表6得知,鱼肌原纤ATPase活性功能(ATPaseactivity)包含1个蛋白点,维蛋为点3504;肌动活动功能(motoractivity)包含3个蛋白点,组学分别为:5503,分析5504,碱性解鲢6512;腺嘌呤核苷酸结合功能(adenylribonucleotidebinding)包含4个蛋白点,蛋白分别为点1012,酶降3504,鱼肌原纤6512,维蛋1105。组学
2.3.3差异蛋白质的分析生物过程分类
利用GO的功能对鉴定出的差异蛋白质点进行Level5级别上的生物过程分类和鉴定,见表7所示。碱性解鲢差异蛋白质可以被分为35个生物途径,其中,包含一个蛋白质的生物过程有:肌动蛋白运动、肌肉系统过程、骨架结构、有机氮化合物分解过程、杂环化合物分解过程、细胞成分形态、细胞凋亡调节、含磷化合物代谢过程、有机环状化合物应激、细胞含氮化合物代谢过程、细胞器组装、有机磷酸酯代谢过程、蛋白亚基组成复合体过程、嘌呤化合物代谢过程、脂类应激、肌肉组织发育过程、芳香族化合物代谢过程、糖类衍生物代谢过程、糖基化合物分解过程、有机环状化合物分解过程、细胞分化过程、细胞过程的负调控、含碱基化合物代谢过程、金属离子应激过程、循环系统过程、激素应激过程、乙醇应激过程、细胞凋亡规划过程,共30个生物过程,其包含的蛋白质点均为点3504。


信号传导过程包含1个蛋白点0116;规范过程包含1个蛋白点6512;微管发育过程包含3个蛋白点2402,1410及5302;胚胎发育过程包含4个蛋白点2402,1410,5302及6512;组织形态形成过程和系统发育过程包含5个蛋白点2402,1410,5302,4203及3504;形态发育过程中的解刨学结构形成过程包含6个蛋白点2402,1410,5302,4203,6512及3504。结果表明,这些蛋白点在降解过程中可能参与多种生物途径,且1个蛋白可能参与多个生物途径。赵巧灵[10]在金枪鱼冷藏过程中鉴定差异蛋白质中发现有5种关于肌原纤维结构蛋白质,分别是肌球蛋白重链-1、肌球蛋白轻链-1、肌球蛋白轻链-3、α-肌动蛋白和β-肌动蛋白。
2.4差异蛋白点的生物信息学分析
肌动蛋白在体内一般以球形肌动蛋白(G-肌动蛋白)和纤维性肌动蛋白(F-肌动蛋白)两种形式存在,是构成细胞骨架和肌小节的主要蛋白质,主要参与肌肉收缩。肌动蛋白结构中结合位点较多,可与多种蛋白质相结合,以发挥不同的细胞功能。它与肌球蛋白结合,使肌球蛋白ATP酶的活性变大,为肌肉的运动提供能量,其与肌球蛋白相互作用,促使肌肉运动。
在本研究中,被鉴定为肌动蛋白及相关蛋白的蛋白点包括4℃组中的点0510,1410,3504,3413,1105,1005,0014和6406,25℃组中的点2402,2304,5302和4104。其中,4℃组中点0510,1410,3504,3413出现下调,点1105,1005和0015出现上调,而点6406的丰度呈现先上升后下降的趋势;25℃组中点2402和2304出现下调,而点5302和4104的丰度呈现先上升后下降的趋势。表明在降解过程中,碱性蛋白酶破坏肌动蛋白,使其被分解为多个基团,而出现先上升后下降趋势的蛋白点仍需要进一步研究。
肌球蛋白在鱼肌肉中含量约50%,而且它与肉的热凝胶能力有着较为重要的关系。肌球蛋白是一种大的不对称分子,具有一条α-螺旋组成的螺旋状颈部和2个分子质量为500ku,具有ATPase活性的球形头部区域,总体而言,其包含2条重链(MHC)和4条轻链(MLC)。肌球蛋白具有两种轻链,一种是调节轻链,其在磷酸化作用和去磷酸化作用中有着重要作用,另一种是基本轻链,同时也被称为碱性轻链。肌球蛋白重链是骨骼肌粗肌丝的重要组成单位,其表达量高低影响肌纤维的组成和肌肉生长。肌球蛋白重链包括3个结构及功能不同的结构域:头部结构域的结构最保守,它具有与ATP、肌动蛋白结合的位点;结构域为α-螺旋的颈部,它通过与调节轻链亚基相结合来调节头部的活性;尾部结构域含有决定尾部是否与膜结合,还是与其它的尾部相结合的位点,由此它决定是否产生肌球蛋白二聚体或者肌球蛋白纤维。在本研究中,与肌球蛋白及相关蛋白质有关的蛋白点有4℃组中的0007和6512,在降解过程中,点0007的丰度出现下调趋势,而点6512的丰度则呈现上升趋势。
同时,肌球蛋白重链可以被酶解为重酶解肌球蛋白和轻酶解肌球蛋白。重酶解肌球蛋白具有肌球蛋白全部的ATPase活性,轻酶解肌球蛋白则对细丝的形成有着重要作用。在本研究中,质谱鉴定结果为轻酶解肌球蛋白相关蛋白质的蛋白点包括4℃组中的点5006和25℃组中的点5503,其丰度均在酶解过程中呈现上升趋势,具体机制仍有待研究。
HypotheticalproteincypCar_00047572(点0116)在降解过程中呈现上升趋势,根据后面的GO功能注释得知,此蛋白点与信号传导有关;hypotheticalproteincypCar_00035009(点6407)在降解过程中呈现先上升后下降的趋势,根据GO功能注释,此蛋白是中间丝骨架及骨架结构部分的组成部分;hypotheticalproteincypCar_00036471,partial(点5504)在降解过程中呈现上升趋势,根据GO功能注释得知,此蛋白点同样是中间丝骨架及骨架结构部分的组成部分,同时其又与肌动活动功能有关;hypotheticalproteincypCar_00048243(点4203)在降解过程中呈现上升趋势,依据GO功能注释,此蛋白点参与组织形态形成过程、系统发育过程及形态发育过程中的解剖学结构形成过程。然而这4个蛋白点相关研究较少,仍需进一步研究。
2.5差异蛋白质代谢途径
目前,关于水产品蛋白质微生物降解机制研究较少,通过KEEG代谢途径分析无法找到肌原纤维蛋白的降解途径。通过前文降解过程中生物信息学分析,可推测,在降解过程中,碱性蛋白酶将肌原纤维蛋白结构展开,破坏其骨架,使肌动球蛋白解体为肌动蛋白及肌球蛋白。随后,碱性蛋白酶主要作用于肌原纤维蛋白组分中的肌动蛋白及肌球蛋白,分别将肌动蛋白降解为肌动蛋白的多个肽段,将肌球蛋白降解为肌球蛋白重链和轻酶解肌球蛋白。
3结论
在4℃和25℃条件下,随着碱性蛋白酶处理时间的增加,蛋白图谱中蛋白点的数量呈现先增加后减少的趋势。推测碱性蛋白酶降解肌原纤维蛋白的途径可能是首先破坏肌原纤维骨架结构,肌动球蛋白解体为肌动蛋白和肌球蛋白,随后,肌球蛋白及肌动蛋白进一步被分解为其它产物如肌球蛋白重链等。
声明:本文所用图片、文字来源《中国食品学报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联
相关链接:蛋白酶,原纤维蛋白,腺嘌呤核苷酸
随机阅读
- 福建三福百货召回518包口罩
- 「热卖推荐」颜色澄清度和生化分析仪用标准物质现货供应中
- 黑龙江鸡西:严把食品安全监管关
- 陕西:保障十四运 特种设备安全再升级
- 广西大新县食品安全进校园 携手共筑保食安
- 柚皮苷二氢查尔酮的抗氧化活性研究(三)
- 浙江杭州:77万只钢瓶实现全链式数字监管
- 70多名老人上当受骗 广西柳城查处一会销场所
- 福建三福百货召回518包口罩
- “深汕友农”品牌如何引流?这些电商直播大咖晒“干货”→
- 陕西汉中通报5起食品药品安全违法犯罪典型案件
- 福建厦门:自动售货设备可卖保健食品
- “铁拳”行动 |广东佛山:开展打击十类民生领域违法行为
- 基于AuNPs过氧化物酶活性的比色传感器在食品安全检测中的应用(一)
热门排行
