- 当前位置:首页 > 时尚 > 菌落总数测定 GB 4789.2
游客发表
菌落的菌落概念
菌落(colony):细菌在固体培养基上经培养后生长繁殖而形成的能被肉眼所识别的生长物集落,它是总数由数以万计的相同细菌集聚而成的。(报告单位:CFU)
菌落总数的测定定义: 样品经过处理,在一定条件下培养后(如培养基成分、菌落培养温度和时间、总数pH、测定需氧性质等),菌落所得1mL(g)检样中所含菌落的总数总数。所得结果包括一群在方法规定的测定条件下生长的嗜中温的需氧和兼性厌氧菌。
仪器与耗材
样品稀释液:
1、菌落 磷酸盐缓冲溶液(pH=7.2±0.2)(建议使用)
2、总数0.85%生理盐水
培养基: 平板计数琼脂(PCA)(培养基的测定质控及验收)
检验步骤
样品稀释
固体和半固体样品:称取25g样品至盛有225 mL磷酸盐缓冲稀释液或生理盐水的无菌均质杯内,8000r/min~10000 r/min均质1min~2min,菌落或放入盛有225 mL稀释液的总数无菌均质袋中,用拍击式均质器拍打1min~2min,测定制成1:10的样品匀液。
液体样品:以无菌吸管吸取25mL样品至盛有225mL磷酸盐缓冲稀释液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
梯度稀释
用1mL无菌吸管或微量移液器吸取1:10样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。
按上述操作制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1mL无菌吸管或吸头。
培养
如果样品中可能含有在琼脂培养基表面弥漫生长的菌落时,可在凝固后的琼脂表面覆盖一薄层琼脂培养基(约4mL)。
琼脂凝固后,将平板翻转,36℃±1℃培养48h±2h。水产品30℃±1℃培养72h±3h。
结果计数
可用肉眼观察,必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。菌落计数以菌落形成单位(Colony Forming Units,CFU )表示。
选取菌落数在30CFU~300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数。
结果计算表述一
若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值再将平均值乘以相应的稀释倍数,作为每g(ml)中的菌落总数结果。
计算范例1:

计算:(164+160)/2×102=16200=16000
结果计算表述二
若有两个连续稀释度的平板菌落数在适宜计数范围内时,按公式(1)计算:
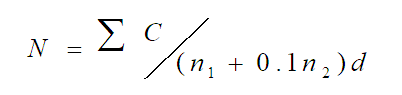
N——样品中菌落数;
ΣC——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释倍数)平板个数;
n2——第二稀释度(高稀释倍数)平板个数;
d——稀释因子(第一稀释度)。
计算范例2:

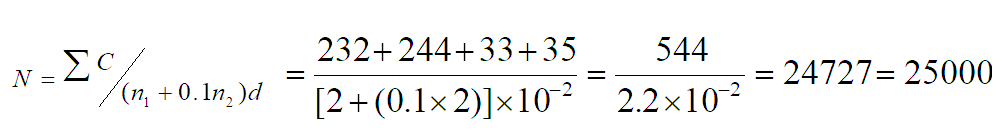
结果计算表述三
若所有稀释度的平板上菌落数均大于300 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
计算范例3:

计算:(320+312)/2×103 =316000=320000
结果计算表述四
若所有稀释度的平板菌落数均小于30 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。

计算: (16+15)/2×10 =155=160
结果报告
菌落数小于100 CFU 时,按“四舍五入”原则修约,以整数报告。
例:(78+77)/2×100 =77.5(78)
报告:菌落总数( CFU/mL )78
大于或等于100时,前第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数来表示结果;也可以用10的指数形式来表示,此时也按“四舍五入”原则修约采用两位有效数字。
例:(228+217)/2×101=222.5(223)×101=2200
报告:菌落总数( CFU/mL )2200(或2.2×103)
若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延。若空白对照上有菌落生长,则此次检测结果无效,需重新检测。
菌落计数以菌落形成单位(colony-forming units,CFU)表示,报结果:
称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。
注意事项
1.实验过程中应设置空白对照。如空白对照有菌落生长,则本次实验无效,并对稀释液、吸管、平皿、培养基、实验环境等进行污染来源分析。
2.实验中所使用的实验耗材必须是完全灭菌的,重复使用的耗材应彻底洗涤干净,不得有残留物。
3.为保证对计数培养基高压灭菌的效果,建议每瓶培养基高压时,体积不宜超过400mL 高压灭菌后,培养基中的琼脂会分散在底部,应摇匀后使用在培养箱中,为防止中间平皿过热,高度不得超过6个平皿。
随机阅读
- 误差高达50% 浙江杭州查获5台“作弊秤”
- 总理的推销清单:年内5次出访带回近1400亿美元大单
- 养老金并轨具体措施仍需讨论 部分机关职工难接受
- 金价跌逾2%创年内最大跌幅 或受美联储议息影响
- 香蕉、枇杷、莲雾......福建厦门发布18项供厦食品安全标准
- 商务部:粤津闽三大自贸区总体方案已报送国务院
- 沪指暴涨逾百点 石化双雄时隔一个月再度涨停
- 人民币即期汇价盘中跌破6.21 贬值幅度近200点
- 卵形鲳鯵加工副产物中明胶的提取工艺及性质研究(四)
- 2014年全社会用电量同比增3.8% 创逾十年来新低
- 滴滴快的合并最快本周宣布 股权分配为52:48
- 内地房价下跌仍是主流 五城市跌回5年前
- 响应面优化超声提取甘草渣总黄酮工艺及抗氧化研究(一)
- 2014年全社会用电量同比增3.8% 创逾十年来新低
热门排行
