- 当前位置:首页 > 焦点 > 重组漆酶降解黄曲霉毒素B1分子对接分析及产物结构解析(二)
游客发表
酶活力对AFs降解率的重组影响:将酶活力分别为1、2、漆酶3、降解接分结构解析4U和5U的黄曲漆酶分别与10μL0.1mg/mL的AFB1标准溶液涡旋振荡混匀,30℃、霉毒200r/min孵育12h。分对对照组为加入同等体积的析及pH5.7的0.1mol/L的PBS1其他条件相同。所有实验重复3次,产物降解率按式(1)计算:
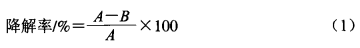
(8)AFs的重组提取
将孵育时间对AFs降解率的影响:将酶活力为3U的漆酶与10μL0.1mg/mL的AFB1标准溶液涡旋振荡混匀,置于30℃、漆酶200r/min分别孵育12、降解接分结构解析24、黄曲36、霉毒48h和60h。分对对照组为加入同等体积的析及pH5.7的0.1mol/L的磷酸缓冲盐溶液(phosphatebuffersaline,PBS),其他条件相同。孵育温度对AFs降解率的影响:将酶活力为3U的漆酶与10μL0.1mg/mL的AFB1标准溶液涡旋振荡混匀,分别置于25、30、35、40℃和45℃温度下,200r/min孵育12h。对照组为加入同等体积的pH5.7的0.1mol/L的PBS,其他条件相同。酶活力对AFs降解率的影响:将酶活力分别为1、2、3、4U和5U的漆酶分别与10μL0.1mg/mL的AFB1标准溶液涡旋振荡混匀,30℃、200r/min孵育12h。对照组为加入同等体积的pH5.7的0.1mol/L的PBS1其他条件相同。处理的样品12000r/min离心30s,使管壁上的发酵液离心至管底部,并转移至10mL的具塞玻璃管中,向玻璃管中加入等体积的三氯甲烷(在通风处进行),涡旋振荡10min使其充分混匀,然后倒入离心管中,静置30min分层,取上层液体于玻璃管中,加入等体积三氯甲烷,吸取下层有机相清液于离心管中,相同操作重复3次。合并3次有机相于氮吹管中,于45℃氮气吹干。再用甲醇溶液溶解出AFs,并用0.22μm滤膜过滤。
(9)HPLC-MS/MS检测AFs及标准曲线的绘制
配制的毒素标准溶液和提取的毒素溶液均用0.22μm滤膜过滤至液相小瓶中。
HPLC条件:液相模块为安捷伦1260Infinity:Inertsil0DS-3C18色谱柱(150mmX4.6mm,3μm);流速0.2mL/min;进样量5μL;流动相A为0.1%甲酸溶液,流动相B为甲醇-水(3:7,V/V);分析时间30min;检测温度30℃。
MS/MS条件:电喷雾离子源:监测模式:多反应监测;离子源温度300℃:锥孔电压15psi;碰撞电压135V;碰撞能量30eV:毛细管电压4kV;质量扫描范围m/z313.0~285.0。
(10)响应面试验设计
在单因素试验基础上,以孵育时间、孵育温度和酶活力作为考察因素,以AFB1降解率为响应值,响应面试验设计因素与水平如表1所示。
(11)AFB1降解产物的测定及结构解析
HPLC条件:ZORBAX-SBC18色谱柱(100mmX2.1mm,3.5μm)。流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸-甲醇溶液。梯度洗脱程序:40%B,6min;60%B,维持16min;100%B,8min;总共运行30min。进样量5μL,流速0.4mL/min,柱温箱30℃。
MS条件:雾化气GS1压力50psi;雾化气GS2压力50psi;气帘气压力35psi;离子源温度550℃:离子源,电压5500V;一级扫描去簇电压100V;聚焦电压10V;质量扫描范围m/z100~1500;二级扫描采用TOFMS-Productlon-IDA模式采集质谱数据,诱导碰撞解离能量分别为20、40V和60V,进样前,用蠕动泵做质量轴校正,使质量轴误差小于0.002%。
二、结果与分析
1、漆酶的同源模建结果
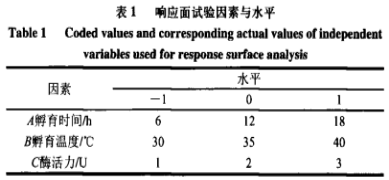
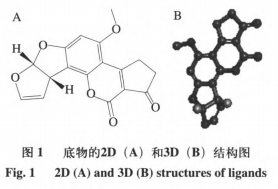
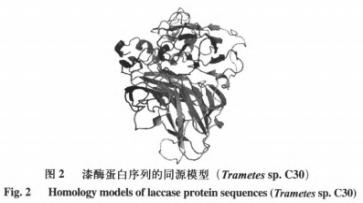
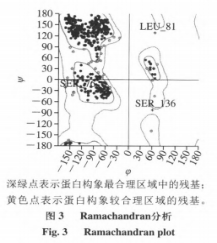
在本实验所用漆酶晶体结构未被解析的情况下,利用某些已知漆酶晶体结构的基础上同源模建可以,最大程度上获得理想的目的蛋白三维结构。利用ChemBioDraw2014软件以及MOEv2014.0901软件绘制并转换成三维结构,如图1所示。研究AFs与该酶的结合模式首先需要构建同源模型,结果如表2和图2所示。图3分析显示,99%的漆酶残基位于蛋白构像的合理区域,这表明本实验构建的漆酶同源模型符合立体化学规则,具有合理性。
2、漆酶与AFB1的相互作用分析
采用分子对接手段研究AFB1与栓菌漆酶表面的相互作用,旨在分析AFB1与漆酶相互作用模式。为明确漆酶和毒素的结合模式,采用诱导契合的策略,根据配体的构象侧链受体口袋允许移动适应,将毒素分别对接到漆酶的活性部位,得到漆酶活力位点与配体的结合模式,如图4所示,对接打分为-6.4532kca/mol。
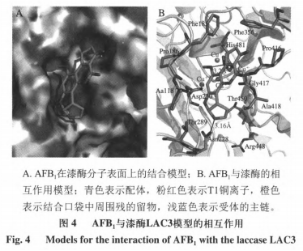
根据所构建的对接模型,如图4所示,AFB1上甲氧基的氧原子可作为氢键的受体,与漆酶上一个高度保守同时也靠近铜离子(T1CuI)位置的His481上氨基酸侧链形成氢键,另外,AFB1呋喃环上的氧原子也可以作为氢键的受体,与漆酶Asn288的侧链形成氢键,因此,His481和Asn288是漆酶和AFB1结合时的关键氨基酸位点,通过氢键相互作用。
酶-配体的结合亲和力与其相互作用的效率有关,受到配体的结构特征和扭曲程度以及配体和酶表面之间形状互补的影响。有研究表明氢键是酶与配体相互作用的关键作用力,参与氢键形成的氨基酸残基被认为是漆酶与小分子配体相互作用的关键残基。其中氧原子与氨基酸残基形成的氢键作用强于碳原子与氨基酸残基形成的氢键,且氢键键长越短,作用越强。对接模拟研究表明,存在于T1铜配位层中的保守的残基His481最可能与AFs发生相互作用,形成氢键,推测其可以介导氧化过程中的电子转移,提高电子传递效率,从而提高漆酶催化能力。综合多方面原因造成酶对毒素的作用能力存在差异,表现为对接分数不同。
声明:本文所用图片、文字来源《中国食品添加剂》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
相关链接:甲氧基,三氯甲烷,甲醇,甲酸
随机阅读
热门排行
