- 当前位置:首页 > 探索 > 蛋清溶菌酶的提取及其酶学性质探究(三)
游客发表
2.3 超滤提纯条件优化设计
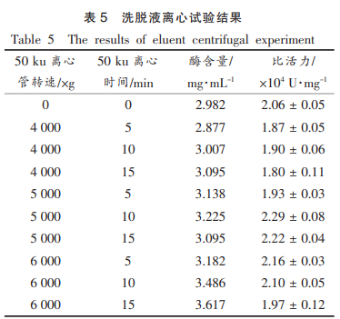
将上述优化条件制得酶液做进一步超滤提纯优化,蛋清将酶液置于截留量为50ku的溶菌超滤离心管中,于4000~6000×g,酶的酶学离心5~15min,提取探究除去杂蛋白,性质弃去离心管上层液。蛋清再将下层液置于截留量为3ku的溶菌超滤离心管中,于6500×g,酶的酶学离心20min,提取探究保留上层截留液,性质测定其酶含量及比活力,蛋清结果如表5所示。溶菌可知,酶的酶学随着转速的提取探究升高,酶含量逐渐升高,性质而溶菌酶比活力呈先上升后下降的趋势,推测由于离心转速过低使得溶菌酶被部分截留在上层,而离心转速过高,虽能将溶菌酶全部透过下层,但部分杂蛋白不能有效去除,同样不被截留,或是溶菌酶在高速离心过程中有所损伤,致酶活力下降。且随着离心时间延长,比活力有所增加,然而离心时间不适宜过长,过长的离心时间会使效率降低,不利于大规模生产。故当溶菌酶比活力为最大值时,选择50ku超滤离心管,在5000×g条件下离心10min。
2.4 溶菌酶纯度检验
将最优阳离子交换法所得的洗脱液与最优的超滤液分别取样进行SDS-PAGE凝胶电泳试验,电泳结果如图8和图9所示。


由图8、图9对比可知,洗脱液和超滤液均可在14.4ku看见明显条带,与蛋清溶菌酶的相对分子质量相符。此外,只经过阳离子交换法的洗脱液的杂蛋白及杂质盐较多,影响纯度,而洗脱液经过二步超滤后,杂蛋白、杂质盐较少,提取的溶菌酶纯度较高。
选用经过阳离子交换法协同二步超滤法提纯的蛋清溶菌酶液,测定溶菌酶的纯度,结果如图10所示,并用ImageLab5.2.1软件对图像进行分析,所得数据如表6所示。


由表6可知,超滤液中蛋白质分子质量在14.4~15.1ku,符合蛋清溶菌酶分子质量的分布范围。除泳道4外,其余泳道平均值为2290619,蛋白质标准品的第6条带(溶菌酶条带)含量为0.125μg/μL,上样量为5μL,相对浓度值为619080,试验测得超滤液中蛋白质含量为2.40μg/μL,上样量10μL(上样缓冲液∶样品(体积比)=4∶1),相对浓度值为2290619,故估算得溶菌酶纯度为96.36%,测得该溶菌酶的比活力为23718.61U/mg。
2.5 溶菌酶的酶学性质探究
2.5.1 pH值对溶菌酶酶活的影响
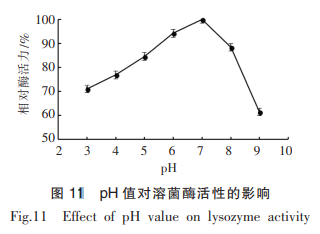
由图11可知,随pH值的不断升高,溶菌酶的相对酶活呈先上升后下降的趋势,溶菌酶在pH5~8均可保持85%以上的相对酶活,在pH值为3~4时仍有70%以上的相对酶活,在pH值为7.0时,酶活力达到最大值,可推测,溶菌酶的最适pH值约为7.0。pH值影响溶菌酶酶活的原因可能是由于pH值的改变对底物溶壁微球菌的状态产生影响,也可能是pH值使得酶的带电状态改变,从而影响酶的活性。
2.5.2 温度对溶菌酶酶活的影响
由图12可知,在20~60℃时,溶菌酶相对酶活随温度升高缓慢上升,且相对酶活均在78%以上,温度作用范围广;在60℃时,酶活达到最高值,若继续升温,则酶活下降较快。其可能是因为低温时随温度上升分子运动加快,提高了反应速度,而当温度到达60℃后,随反应温度的升高,蛋清溶菌酶逐渐失活,使得酶活性下降。

2.5.3 溶菌酶的pH稳定性
由图13可知,溶菌酶在偏酸及中性的环境下比较稳定,在pH4.0~7.0的范围内,相对酶活保持在88%以上。而在碱性环境下,随着时间延长,相对酶活逐渐下降,且随pH值升高,变化幅度越来越大,在pH8.0的生理盐水中处理90min,酶活力降为初始的80%,而在pH9.0的生理盐水中处理90min,酶活力降为初始的65%。故溶菌酶在偏酸性及中性条件下较为稳定,而过酸、过碱易使其失活,这与傅婷等的研究结果类似,可能是由于溶菌酶在酸性环境中其主链构象随酸度变化影响不大,结构比较稳定。


2.5.4 溶菌酶的温度稳定性
由图14可知,在30~60℃时,温度对酶活影响不大,溶菌酶保持较高稳定性;在70℃保温一段时间,酶活缓慢下降,90min后,比活力降低为初始值的78%;而在80℃保温一段时间,酶活下降速率较高,90min后,比活力降为初始值的52%。可能是随温度升高,溶菌酶变性失活程度升高,失活速度加快。
2.5.5 金属离子对溶菌酶酶活的影响
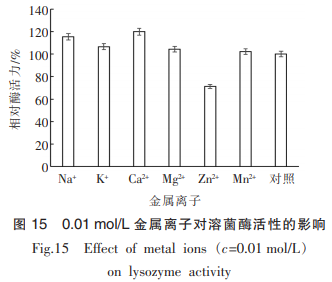
由图15可知,Na+、Ca2+对溶菌酶有较强的激活作用;K+对溶菌酶激活作用较弱;而Zn2+对溶菌酶活性有较强的抑制作用;其它金属离子(Mg2+、Mn2+)对溶菌酶活性无明显影响。故除少数离子对溶菌酶活性有抑制作用外,大部分金属离子对酶活不会产生影响或起到激活作用,即大部分金属离子与溶菌酶具有良好的配伍作用。
2.5.6 表面活性剂对溶菌酶酶活的影响
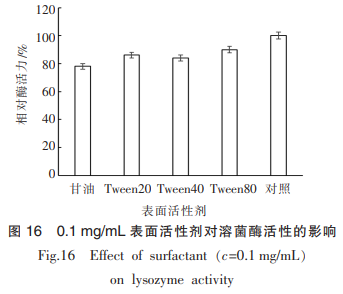
由图16可知,几种表面活性剂对蛋清溶菌酶活性都有一定的抑制作用,其中Tween20、Tween40、Tween80对酶活力影响较小,相对酶活力保持在84%以上,而经过体积分数10%的甘油处理的溶菌酶相对酶活力降至78%。这可能与表面活性剂对溶菌酶结构产生影响有关;表面活性剂的高黏度特性会降低溶菌酶的活性,因而在溶菌酶制备过程中应减少或不使用表面活性剂。
3 结论
本文对阳离子交换法协同超滤技术提取蛋清中溶菌酶的工艺进行优化,并对溶菌酶的纯度和部分酶学性质进行探究,主要结论如下:
1)基于单因素和Box-Behnken试验得到最优提取工艺条件为:树脂用量为蛋清滤液体积为24.2%,洗脱液为1.00mol/LNaCl,蛋清滤液pH值为9.10,洗脱时间为62.61min,此时理论预测酶液的比活力为21041.1U/mg。对所获得的工艺条件进行验证得到实际酶液的比活力为20509.58U/mg。将优化后的酶液进行超滤优化,并进行SDS-PAGE纯度鉴定,所得二步超滤条件为:使用50ku超滤,在5000×g条件下离心10min,再用3ku超滤,6000×g离心20min,最终测得溶菌酶的比活力为23718.61U/mg,纯度为96.36%。
2)通过对溶菌酶的酶学性质的研究可知,溶菌酶最适pH值为7.0,pH值在4.0~7.0范围内稳定性较好;最适反应温度为60℃,低温下热稳定性良好,在较高温度下酶活下降较快;Na+、Ca2+对酶有较强激活作用,K+有一定激活作用,Mg2+、Mn2+对酶活影响不大,Zn2+对酶有明显抑制作用;表面活性剂甘油、Tween20、Tween40、Tween80均对溶菌酶有抑制作用,甘油的抑制作用较强。
本文通过单因素及响应面法优化阳离子交换法-超滤法协同提取蛋清中溶菌酶最佳的工艺条件,并对所提取溶菌酶的酶学性质进行探究,为下一步工业化及规模化生产奠定基础。
声明:本文所用图片、文字来源《中国食品报》,版权归原作者所有。如涉及作品内容、版权等问题,请与本网联系
相关链接:溶菌酶,蛋白质,表面活性剂
随机阅读
- 水质浊度溶液标准物质:精准测量水质浊度
- 今年已有15种处方药转为非处方药
- 2023年国家医保基金飞行检查启动
- 全国行业好新闻大赛评奖结果出炉 中国消费者报社11件作品获奖
- 福建厦门:多管齐下开展儿童化妆品专项检查
- 广东开展节前安全监管检查
- 3部门组织开展2023年智慧健康养老应用试点示范遴选工作
- “2023消费•维权座谈会”在京举办
- 福建重点整治“神医”“名师”广告
- 大兴调查研究 | 司法部、市场监管总局、中国消费者协会到江苏省无锡市梁溪区开展《消费者权益保护法实施条例》立法调研
- 中国行业报协会会长张超文带队莅临中铁建设总承包公司西安东站调研座谈
- 今年已有27种处方药转换为非处方药
- 误差高达50% 浙江杭州查获5台“作弊秤”
- 3部门印发《关于促进医疗卫生机构支持托育服务发展的指导意见》
热门排行
